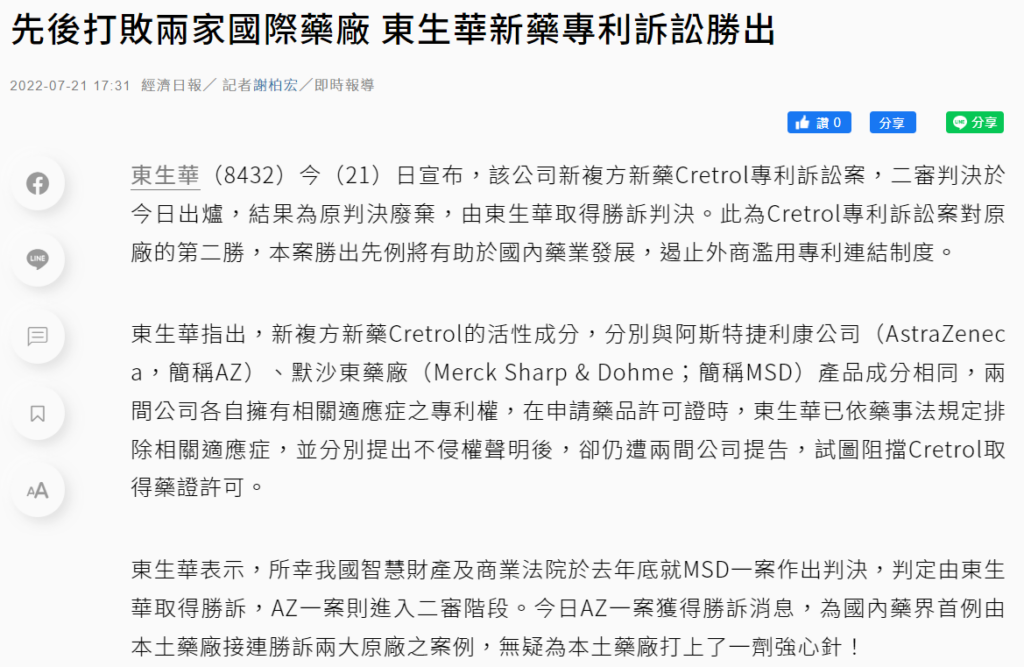
前言:
東生華新藥Cretrol前後分別與阿斯特捷利康公司(AstraZeneca,簡稱AZ)、默沙東藥廠(Merck Sharp & Dohme;簡稱MSD)的專利訴訟案中取得勝訴判決。本次文章將會依據判決書分析各案件訴訟過程,並進一步透過連結專利法以及藥事法說明。
新藥Cretrol背景介紹
- 脂瑞妥Cretrol簡介
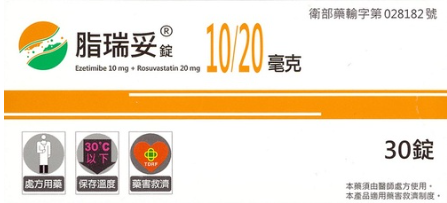

- 脂瑞妥Cretrol仿單資料

- 脂可妥(脂瑞妥前身)資料簡介
脂可妥於申請藥品許可證時,依據藥事法第48條之12、第48條之20及西藥專利連結施行辦法第11條規定聲明(下稱P4聲明),未侵害「怡妥錠」所對應之系爭專利。
「藥事法第 48-12 條
1. 學名藥藥品許可證申請案涉及第四十八條之九第四款之聲明者,申請人應自中央衛生主管機關就藥品許可證申請資料齊備通知送達之次日起二十日內,以書面通知新藥藥品許可證所有人及中央衛生主管機關;新藥藥品許可證所有人與所登載之專利權人、專屬被授權人不同者,應一併通知之。
2. 申請人應於前項通知,就其所主張之專利權應撤銷或未侵害權利情事,敘明理由及附具證據。
3. 申請人未依前二項規定通知者,中央衛生主管機關應駁回該學名藥藥品許可證申請案。」
「藥事法第 48-20 條
1. 新成分新藥以外之新藥,準用第四十八條之九至第四十八條之十五關於學名藥藥品許可證申請之相關規定。
2. 第四十八條之十二之學名藥藥品許可證申請案,符合下列各款要件者,不適用第四十八條之十三至第四十八條之十八關於暫停核發藥品許可證與銷售專屬期間之相關規定:
一、已核准新藥所登載之專利權且尚屬存續中者,屬於第四十八條之三第二項第三款之醫藥用途專利權。
二、學名藥藥品許可證申請人排除前款醫藥用途專利權所對應之適應症,並聲明該學名藥未侵害前款之專利權。
3. 前項適應症之排除、聲明及其他應遵行事項之辦法,由中央衛生主管機關定之。」
「西藥專利連結施行辦法第11條
1. 學名藥藥品許可證申請人依本法第四十八條之十二第一項規定所為之書面通知,其內容應就專利權有應撤銷之事由或未侵害專利權之理由逐一敘明,並附具相關證明文件、資料。
2. 前項通知,應以附回執之雙掛號郵件交付郵務機構寄送,並於全部送達後之次日起二十日內,將所有回執影本或其他足以證明送達之文件,送中央衛生主管機關。」
依藥事法第7條規定「本法所稱新藥,係指經中央衛生主管機關審查認定屬新成分、新療效複方或新使用途徑製劑之藥品」,脂可妥於申請藥品許可證時,便以怡妥錠為對照藥並聲明怡妥錠所對應之專利權。理由中說明脂可妥包含之活性成分Rosuvastatin calcium及Ezetimibe,與怡妥錠的活性成分Ezetimibe有所不同,以證明脂可妥並非怡妥錠之學名藥(註1),應屬為藥事法第48條之20第1項所規定之「新成分新藥以外之新藥」。
註1:依據藥品查驗登記審查準則第4條第一項第二款之定義,學名藥係指與國內已核准之藥品具同成分、同劑型、同劑量、同療效之製劑。意謂學名藥與原廠藥具有相同之有效成分、劑型、劑量及療效。
智慧財產及商業法院110年度民專訴字第4號判決
- 雙方資料簡介 原告被告 默沙東藥廠(Merck Sharp & Dohme Corp.)東生華製藥股份有限公司
藥品名稱衛署藥輸字第024058號新藥
怡妥錠10公絲EZETROL TABLETS 10MG」藥品(下稱「怡妥錠」)學名藥
1.脂可妥錠10/20毫克(Cretrol Tab. 10/20mg)及
2.脂可妥錠10/10毫克(Cretrol Tab. 10/10mg)藥品
(脂可妥為改版前脂瑞妥)
專利號I337076號氮雜環丁烷酮化合物於治療β-穀甾醇血症之用途(系爭專利)
專利權其間:100/02/11-111/01/24
(110/07/02提出更正第31項)
- 默沙東藥廠提告依據
藥事法第 48-12 條說明藥品許可證申請人依藥事法第48條之9 第4 款規定為聲明有已核准新藥所登載之專利權者將會一併接獲通知。而對專利權人於接獲通知後,得依專利法第96條第1 項規定,請求除去或防止侵害。
- 主文
原告之訴及假執行之聲請均駁回。
訴訟費用由原告負擔。
- 雙方主張
原告(默沙東藥廠)主張
1. 原告依據脂可妥的仿單資料中認為脂可妥用於治療原發性高膽固醇血症(primary hypercholesterolemia),必定包含治療sitosterolemia(穀甾醇血症或麥硬脂過多症)患者之高膽固醇血症,且脂可妥之活性成分及劑量均已落入系爭專利所界定之範圍。主張脂可妥落入系爭專利請求項1至6、8至9、11、14及更正後請求項31之文義範圍,已侵害系爭專利。
2. 系爭藥品之活性成分及劑量均已落入系爭專利所界定治療β-穀甾醇血症之範圍,已侵害系爭專利。依藥事法第48條之13第1項、專利法第96條第1 項後段、民法第767 條第1 項後段、第2 項等規定請求防止侵害。並聲明:被告不得直接或間接、自行或委請他人製造、為販賣之要約、販賣、使用及進口系爭藥品;原告願以現金或同額之可轉讓定期存單供擔保,請准宣告假執行。
被告(東生華)主張
1. 系爭專利於99年11月19日核准審定,應適用99年9月12日施行之專利法及98年版之專利審查基準。
2. 系爭藥品並未落入系爭專利請求項1至6、8至9、11、14、更正後請求項31之文義侵權範圍,從而,原告之請求為無理由等語,並聲明:原告之訴及假執行之聲請均駁回;如受不利判決,願供擔保請准宣告免為假執行。
- 簡化後爭點
系爭藥品是否有落入系爭專利請求項1 至6 、8 至9 、11、14、31之文義侵權範圍?
| 系爭專利 | I337076號氮雜環丁烷酮化合物於治療β-穀甾醇血症之用途 |
| 項次 | 內容 |
| 1 | 一種用於治療β-穀甾醇血症之醫藥組合物,其包含有效量之式(VIII)表示之固醇吸收抑制劑(詳附圖一)、或該固醇吸收抑制劑之醫藥可接受鹽或溶劑合物、或其混合物,於醫藥可接受載劑中。 |
| 2 | 根據申請專利範圍第1項之醫藥組合物,其中該固醇吸收抑制劑以範圍為每日每公斤哺乳動物體重為約0.1 至約30毫克固醇吸收抑制劑之量對哺乳動物施藥。 |
| 3 | 根據申請專利範圍第2項之醫藥組合物,其中該固醇吸收抑制劑以範圍為每日每公斤哺乳動物體重為約0.1至約15毫克固醇吸收抑制劑之量對哺乳動物施藥。 |
| 4 | 根據申請專利範圍第1項之醫藥組合物,其更包含有效量之至少一種降脂劑與該固醇吸收抑制劑組合。 |
| 5 | 根據申請專利範圍第4項之醫藥組合物,其中該降脂劑為HMG-CoA還原酶抑制劑。 |
| 6 | 根據申請專利範圍第5項之醫藥組合物,其中該HMG-CoA還原酶抑制劑選自西伐史塔丁(simvastatin)、羅伐史塔丁(lovastatin)、普瑞伐史塔丁(pravastatin)、弗伐史塔丁(fluvastatin)、阿托伐史塔丁(atorvastatin)、羅蘇伐史塔丁(rosuvastatin)、伊塔伐史塔丁(itavastatin)及其混合物組成之群。 |
| 8 | 根據申請專利範圍第4項之醫藥組合物,其中該固醇吸收抑制劑以範圍為每日每公斤哺乳動物體重為約0.1至約30毫克固醇吸收抑制劑之量對哺乳動物施藥。 |
| 9 | 根據申請專利範圍第4項之醫藥組合物,其中該降脂劑以範圍為每日每公斤哺乳動物體重為約0.1至約80毫克降脂劑之量對哺乳動物施藥。 |
| 11 | 一種治療β-穀甾醇血症之醫藥組合物,其包含:有效量之式(VIII)表示之固醇吸收抑制劑(詳附圖一)、或該固醇吸收抑制劑之醫藥可接受鹽或溶劑合物、或其混合物;有效量之至少一種膽汁酸錯隔劑或其他降脂劑。 |
| 14 | 一種治療β-穀甾醇血症之醫藥組合物,其包含:有效量之式(VIII)表示之固醇吸收抑制劑、或該固醇吸收抑制劑之醫藥可接受鹽或溶劑合物、或其混合物;至少一種固醇生物合成抑制劑,於醫藥可接受載劑中。 |
| 31 | 一種治療組合,其包含(a)第一量之式(VIII)化合物及(b)第二量之降脂劑,其中該第一量係10毫克,該第二量係每日0.1至80毫克/每公斤體重,且其中第一量與第二量一起包含治療哺乳動物之β-穀甾醇血症之治療有效量。 |
- 判決內容簡述:
1. 專利範圍解釋
依據系爭專利申請日(100/02/11),依據105年專利侵權判斷要點規定:
「惟依93年版『專利侵害鑑定要點』及102年前之專利審查實務,用途特徵對於請求項界定之範圍皆具有限定作用,因此,若『用途界定物之請求項』係依102年以前之專利審查基準核准者,於解釋該請求項時,其請求項界定之範圍應受該用途之限定」。
因此,系爭專利符合「用途界定物之請求項」的請求項1界定範圍應受該用途之限定。因此,系爭專利請求項1之「治療β-穀甾醇血症」具有限定作用。
而系爭專利請求項1所述之「有效量」,為治療β-穀甾醇血症之有效量,故應將「一種用於治療β-穀甾醇血症之醫藥組合物」與「包含有效量之式(VIII)表示之固醇吸收抑制劑、或該固醇吸收抑制劑之醫藥可接受鹽或溶劑合物、或其混合物」同列為請求項1之專利要件而判斷脂可妥是否落入系爭專利請求項1之專利權範圍。
2. β-穀甾醇血症(sitosterolemia)定義
β-穀甾醇血症又稱植物脂醇血症,為一種遺傳性脂儲存失調,其特徵為血漿與組織中β-穀甾醇與其他植物固醇含量增加,同時的,也可能導致血漿中膽固醇濃度正常或升高。是以該發明所屬技術領域中具有通常知識者可理解β-穀甾醇血症係造成原發性高膽固醇血症之成因之一,而導致β-穀甾醇血症病患可能產生血漿中LDL膽固醇升高,其他臨床表徵尚包括血漿中β-穀甾醇及其他植物固醇之升高。
3. 脂可妥仿單中關於β-穀甾醇血症說明
脂可妥仿單「Ezetimibe合併使用statin類藥物」項下(脂可妥第二有效成份Rosuvastatin Calcium,即為statin類藥物)未評估所招募患者中是否具有升高之血漿中植物固醇濃度(如β-穀甾醇),脂可妥仿單未揭露系爭藥品可以治療β-穀甾醇血症。
4. 申請系爭專利審查歷史:
系爭專利於再審查階段時之理由書中主張「β-穀甾醇血症」與「高膽固醇血症」是不同適應症,並克服引證文獻(C. Dujovne et al, “Reduction of LDL Cholesteral in Patients with Primary Hypercholesterolemia by SCH 48461: Results of a mutlicenter Dose-Ranging Study”, J. Clin,. Pharm. 41:1 70-78 (Jan. 2001) )取得專利。基於「之申請歷史禁反言」的原則下,不應主張「β-穀甾醇血症」與「高膽固醇血症」可視為相同適應症。
5. 專利藥品(怡妥錠)仿單:
怡妥錠仿單將「高膽固醇血症」與「同型接合子性麥硬脂醇血症(植物脂醇血症)」分列為兩種適應症。雖然脂可妥包含的有效成分Ezetimibe 及Rosuvastatin Calcium中Ezetimibe相同於式(VIII)化合物,惟脂可妥之適應症「原發性高膽固醇血症(不含異型接合子家族性)」與「β-穀甾醇血症」不同,脂可妥未落入系爭專利請求項1之文義範圍。
*請求項2至6、8及9為請求項1之附屬項,包含請求項1之全部技術特徵,由於前述已說明脂可妥並未落入系爭專利請求項1之文義範圍,就該發明所屬技術領域中具有通常知識者可理解脂可妥當未落入系爭專利請求項2至6、8及9之文義範圍。
*基於前述「原發性高膽固醇血症(不含異型接合子家族性)」與「β-穀甾醇血症」為不同之適應症之理由,脂可妥未落入系爭專利請求項11、14以及31之文義範圍。
By Tina
參考資料
https://udn.com/news/story/7241/6478476
https://www.cde.org.tw/faq/faq_more?id=1228
https://www.tshbiopharm.com/ec99/rwd1427/product.asp?prodid=CRETROL1020