前言
東生華新藥Cretrol前後分別與阿斯特捷利康公司(AstraZeneca,簡稱AZ)、默沙東藥廠(Merck Sharp & Dohme;簡稱MSD)的專利訴訟案中取得勝訴判決。本次文章將會依據判決書分析各案件訴訟過程,並進一步透過連結專利法以及藥事法說明。
新藥Cretrol背景介紹
- 脂瑞妥Cretrol簡介
- 脂可妥資料簡介
脂可妥於申請藥品許可證時,依藥事法第7條規定「本法所稱新藥,係指經中央衛生主管機關審查認定屬新成分、新療效複方或新使用途徑製劑之藥品」,並配合藥事法第48條之12、第48條之20及西藥專利連結施行辦法第11條規定(下稱P4聲明),以冠脂妥(阿斯特捷利康公司藥品)為對照藥並聲明無侵害冠脂妥所對應之專利權。脂可妥於申請藥品許可證時,便依財團法人醫藥品查驗中心之建議修改送驗之仿單內容,於申請適用症中原發性高膽固醇血症病人後加註「(不含異型接合子家族性)」並修改對應說明(前述修正後仿單為秘密保持命令文件)。
原始仿單及修正仿單比對:
原始仿單
修正仿單
適應症 原發性高膽固醇血症
適用於作為飲食的輔助療法,用於原發性高膽固醇血症病人(不含異型接合子家族性)或混合型血脂異常病人可降低升高的總膽固醇、低密度脂蛋白(LDL-C)、脂蛋白元(Apo-B)、非高密度脂蛋白膽固醇(non-HDL-C)和三酸甘油酯以及提高高密度蛋白膽固醇(參適應症之第二段說明)。原發性高膽固醇血症(不含異型接合子家族性)
相關法條請參閱文章:東生華 新藥Cretrol專利訴訟案。
智慧財產及商業法院110年度民專訴字第9號判決
- 雙方資料簡介
| 原告 | 被告 | |
| 瑞典商阿斯特捷利康公司(AstraZeneca) | 東生華製藥股份有限公司 | |
| 藥品名稱 |
冠脂妥® 5,10,20毫克 CRESTOR® 5, 10, 20 mg Film-Coated Tablets |
學名藥 1.脂可妥錠10/20毫克(Cretrol Tab. 10/20mg)及 2.脂可妥錠10/10毫克(Cretrol Tab. 10/10mg)藥品 (脂可妥為改版前脂瑞妥) |
| 專利號 |
I238720號 用於治療異質接合家族性血膽固醇過多症之醫藥組合物(系爭專利) 專利權期間:94/9/1-110/11/20 |
無 |
- 阿斯特捷利康提告依據
藥事法第 48-12 條說明藥品許可證申請人依藥事法第48條之9 第4 款規定為聲明有已核准新藥所登載之專利權者將會一併接獲通知。
阿斯特捷利康公司於109年10月26日接獲通知後,依原始仿單所含成分及比例與系爭專利予以比對分析,認被告藥品脂可妥構成對原告專利權之侵害。依藥事法第48條之13第1項規定於45日內提起本件訴訟,並依專利法第96條第1項、民法第767條第1項規定,請求防止被告之侵害。
- 主文
- 被告不得直接或間接、自行或委請他人製造、為販賣之要約、販賣、使用及進口CretrolⓇTab. 10/10mg(中文品名:脂可妥錠10/10毫克)、CretrolⓇTab. 10/20mg(中文品名:脂可妥錠10/20毫克)藥品。
- 訴訟費用由被告負擔。
- 雙方主張
原告(阿斯特捷利康公司)主張
- 原始仿單中,脂可妥適用於治療原發性高膽固醇血症(primary hypercholesterolemia)以及混合型血脂異常病人。雖脂可妥之原始仿單適應症說明中有排除「異型接合子家族性」之原發性高膽固醇血症病人,然而混合型血脂異常病人亦包含系爭專利(原告專利)中所指「患有異質接合家族性血膽固醇過多症之病患」。主張脂可妥落入系爭專利請求項1、5、8之所有特徵,符合文義讀取,構成文義侵權。
被告(東生華)主張
- 修正仿單中,脂可妥適用於治療原發性高膽固醇血症(primary hypercholesterolemia)並排除「異型接合子家族性」(刪除混合型血脂異常病人),應以修正仿單評估是否侵權。
- 依系爭專利核准時之專利審查基準第1篇第8章及智慧局105年2月公告「專利侵權判斷要點」可知,系爭專利所有請求項皆為用途界定物之發明,即使請求標的為「醫藥組合物」,仍應視為物的用途發明,侵權判斷時應比對請求項與被控侵權對象之物及用途,不應只判斷物(即系爭藥品)本身。
基於脂可妥所適用症以排除「異型接合子家族性」,主張脂可妥未落入系爭專利請求項1、5、8之文義或均等範圍。
- 藥事法第48條之1第2項規定「…於中央衛生主管機關核發學名藥藥品許可證前,不得製造或輸入。」換言之,被告就系爭藥品申請查驗登記至取得藥品許可證前,並不得製造、為販賣之要約、販賣、使用或為上述目的而進口系爭藥品。依訴訟時點以及專利權其間,即使被告取得藥品許可證後,系爭專利應早已屆期消滅。
基於被告既未取得藥品許可證,也無侵害或妨害系爭專利之專利權可能,原告即無事先防範被告未來侵害之必要。
- 簡化後爭點
脂可妥是否落入系爭專利請求項1、5、8之文義範圍?
系爭專利內容
| I238720號 | 用於治療異質接合家族性血膽固醇過多症之醫藥組合物 |
| 項次 | 內容 |
| 1 | 一種用於治療患有異質接合家族性血膽固醇過多症之病患之異質接合家族性血膽固醇過多症之醫藥組合物,其包括治療有效量之(E)-7-[4-(4-氟苯基)-6-異丙基-2-[甲基(甲基磺醯基)胺基]嘧啶-5-基](3R,5S)-3,5-二羥基庚-6-烯酸或其醫藥可接受性鹽及醫藥可接受性載體。 |
| 5 | 如申請專利範圍第1至3項中任一項之醫藥組合物,其中使用(E)-7-[4-(4-氟苯基)-6-異丙基-2-[甲基(甲基磺醯基)胺基]嘧啶-5-基](3R,5S)-3,5-二羥基庚-6-烯酸之鈣鹽。 |
| 8 | 一種用於對患有異質接合家族性血膽固醇過多症之病患降低LDL-C、升高HDL-C、降低Apo B及升高Apo A-I之醫藥組合物,其包括治療有效量之(E)-7-[4-(4-氟苯基)-6-異丙基-2-[甲基(甲基磺醯基)胺基]嘧啶-5-基](3R,5S)-3,5-二羥基庚-6-烯酸或其醫藥可接受性鹽及醫藥可接受性載體。 |
脂可妥仿單

依據原始仿單或修正仿單記載,脂可妥主要活性成分均為「Rosuvastatin calcium」及「Ezetimibe」
- 判決內容簡述:
- 專利範圍請求項1解釋:
系爭專利請求項1符合「用途界定物之請求項」,其範圍應受該用途之限定。因此,系爭專利請求項1之「治療患有異質接合家族性血膽固醇過多症」具有限定作用。
專利請求項1之技術特徵:
(1)「一種用於治療患有異質接合家族性血膽固醇過多症之病患之異質接合家族性血膽固醇過多症之醫藥組合物,其包括治療有效量之(E )-7-[4-(4-氟苯基)-6-異丙基-2-[甲基(甲基磺醯 基)胺基]嘧啶-5-基](3R,5S)-3,5-二羥基庚-6-烯酸或其醫藥可接受性鹽」
(2)「醫藥可接受性載體」
- 專利範圍請求項8解釋:
如上述可知,專利請求項8之技術特徵:
(1)「一種用於對患有異質接合家族性血膽固醇過多症之病患降低LDL-C、升高HDL-C、降低Apo B及升高Apo A-I之醫藥組合物其包括治療有效量之 (E)-7-[4-(4-氟苯基)-6-異丙基-2-[甲基(甲基磺醯基)胺基]嘧啶-5-基](3R,5S)-3,5-二羥基庚-6-烯酸或其醫藥可接受性鹽」
(2)「醫藥可接受性載體」
- 脂可妥技術特徵內容:
(1) 適應症為「原發性高膽固醇血症(不含異型接合子家族性)」,且有效成分之一為Rosuvastatin calcium。
(2)錠劑含有醫藥上可接受之載劑
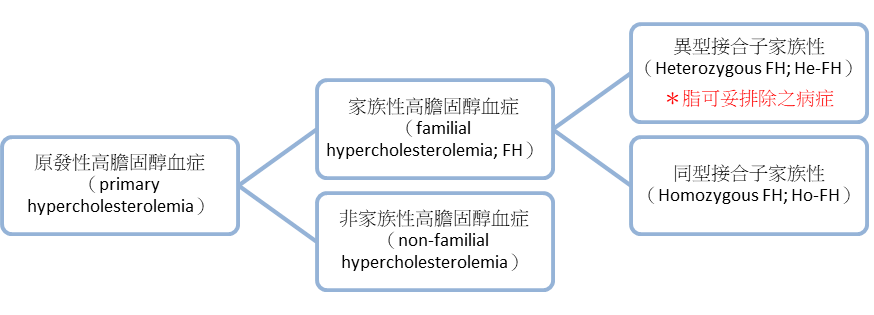
- 參酌各證物中定義「原發性高膽固醇血症」、「異型接合子家族性高膽固醇血症」及「同型接合子家族性高膽固醇血症」
(1)原發性高膽固醇血症(primary hypercholesterolemia)與內在基因遺傳有關,可能是由單一遺傳缺陷所致(家族性),或更常見由數種基因與飲食和其他因素相互作用所致(非家族性)。病況特徵為降低數量之官能LDL受體,因此與LDL增加而升高之血清LDL-C量有關。
(2)家族性高膽固醇血症(FH)可再分為「異型接合子」家族性(HeterozygousFH;HeFH)以及「同型接合子」家族性(HomozygousFH;HoFH),屬罕見疾病。
(3)異型接合子家族性(HeterozygousFH;HeFH)發生機率約1/500,血液中LDL粒子約 介於190-350mg/dl之間;同型接合子家族性(HomozygousFH;HoFH)發生機率為1/1,000,000,血中LDL-C可能高達600mg/dl以上。
- 脂可妥仿單所引用之人體臨床試驗結果,賦予脂可妥本身的療效。
仿單對於臨床醫事或藥事人員係為藥品使用指引,判斷是否落入系爭專利請求項1之範圍時具有重要參考價值,應考量脂可妥本身療效可否為仿單所引用之臨床試驗結果所支持而具有醫療合理性。
依據各項證據以及證人童綜合醫院內分泌暨新陳代謝科主任以及品安診所家庭醫師證述:
(1) 臨床醫師於治療高膽固醇血症病患時,並不會以基因檢測方式去鑑別病患是否屬於異型接合子家族性高膽固醇血症病患。
(2) 超過20%會造成家族性高膽固醇血症的基因突變尚未被辨識。
(3)異型接合子家族性高膽固醇血症(HeFH)以及同型接合子家族性高膽固醇血症(HoFH)無法從臨床去區分。
可合理推知:
(1)縱使使用基因檢測技術,亦無法完全區分原發性高膽固醇血症病患族群中非屬異型接合子家族性高膽固醇血者之患者。
(2)脂可妥仿單臨床試驗所招募之11308位原發性高脂血症的患者,可能含有至少100位之異型接合子家族性高膽固醇血症病患,惟其餘均為非家族性原發性高膽固醇血症病患,應未有同型接合子家族性高膽固醇血症病患。
故仿單所引用之臨床試驗結果,並無法證明系爭藥品具有治療「同型接合子家族性高膽固醇血症」之效益,脂可妥仿單之適應症「原發性高膽固醇血症(不含異型接合子家族性)」,並不具醫療合理性,僅係被告針對系爭專利請求項1於字面上文義所為刻意迴避。
- 脂可妥是否落入系爭專利:
脂可妥活性成分之一為Rosuvastatin calcium,即為「(E)-7-[4-(4-氟苯基)-6-異丙基-2-[甲基(甲基磺醯基)胺基]嘧啶-5-基](3R,5S)-3,5-二經基庚-6-烯酸」之鈣鹽,且Rosuvastatin calcium含量為10.4或20.8毫克為可產生治療異型接合子家族性高膽固醇血症之治療有效量,已落入系爭專利之請求項1以及請求項8之文義範圍而構成侵權。
- 原告係於109年10月26日接獲被告之「P4聲明」通知,依藥事法第48條之13第2項規定,被告將於12個月之暫停核發藥品許可證期間過後,即於110年10月27日之後可能取得系爭藥品之許可證而得開始為製造、販售、進口系爭藥品等行為,此際系爭專利仍處於有效期間(110年11月20日止)。
依藥事法第48之9條為相關聲明時,本可主張第3款「該新藥對應之專利權消滅後,始由中央衛生主管機關核發藥品許可證」即可,被告捨此不為,仍選擇P4聲明,顯有於系爭專利屆期日前欲儘快取得藥品許可證之冀望,此與被告認其於110年11月底以前並無可能取得藥品許可證,相互矛盾。
因此,被告現在申請之藥品脂瑞妥,已足使原告確定且預期被告將來侵權行為之發生,當屬「有侵害之虞」,准予原告依專利法第96條第1項或民法第767條規定請求被告不得直接或間接、自行或委請他人製造、為販賣之要約、販賣、使用或進口系爭藥品。
參考資料
https://www.fda.gov.tw/TC/cases.aspx